11月22日,信立泰發(fā)布公告稱,公司自主研發(fā)的創(chuàng)新小分子藥物SAL0119片臨床試驗(yàn)申請(qǐng)獲得受理,目前擬開發(fā)臨床適應(yīng)癥包括活動(dòng)性強(qiáng)直性脊柱炎及中重度活動(dòng)性類風(fēng)濕關(guān)節(jié)炎。截至目前,信立泰在今年已申報(bào)了4款1類新藥。
圖1:信立泰最新申報(bào)的產(chǎn)品情況
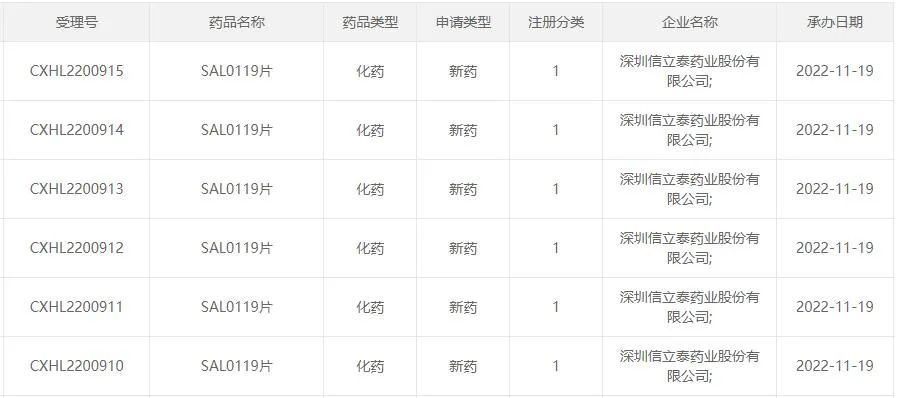
來源:CDE官網(wǎng)
信立泰在公告中提到,SAL0119片是一款口服小分子免疫抑制劑,目前擬開發(fā)臨床適應(yīng)癥包括活動(dòng)性強(qiáng)直性脊柱炎及中重度活動(dòng)性類風(fēng)濕關(guān)節(jié)炎。強(qiáng)直性脊柱炎(AS)和類風(fēng)濕關(guān)節(jié)炎(RA)均屬于自身免疫疾病,目前該疾病的發(fā)病原因尚不完全明確,且無法治愈。SAL0119具有獨(dú)特的不同于JAK類的作用機(jī)制和廣譜的細(xì)胞因子抑制作用,臨床前研究數(shù)據(jù)體現(xiàn)出良好的有效性和安全性。
圖2:國內(nèi)免疫抑制劑的銷售情況(單位:萬元)

來源:米內(nèi)網(wǎng)格局?jǐn)?shù)據(jù)庫
近年來,隨著越來越多新品獲批進(jìn)入市場(chǎng),免疫抑制劑的整體銷售規(guī)??焖偕蠞q,米內(nèi)網(wǎng)數(shù)據(jù)顯示,2021年在三大終端6大市場(chǎng)(統(tǒng)計(jì)范圍見文末)免疫抑制劑的合計(jì)銷售額已超過250億元,公立醫(yī)院終端(城市公立醫(yī)院+縣級(jí)公立醫(yī)院)是主戰(zhàn)場(chǎng),占比達(dá)八成以上,零售藥店終端(城市實(shí)體藥店+網(wǎng)上藥店)的增速較快,最近兩年均保持雙位數(shù)增長。
圖3:今年以來信立泰申報(bào)的1類新藥情況
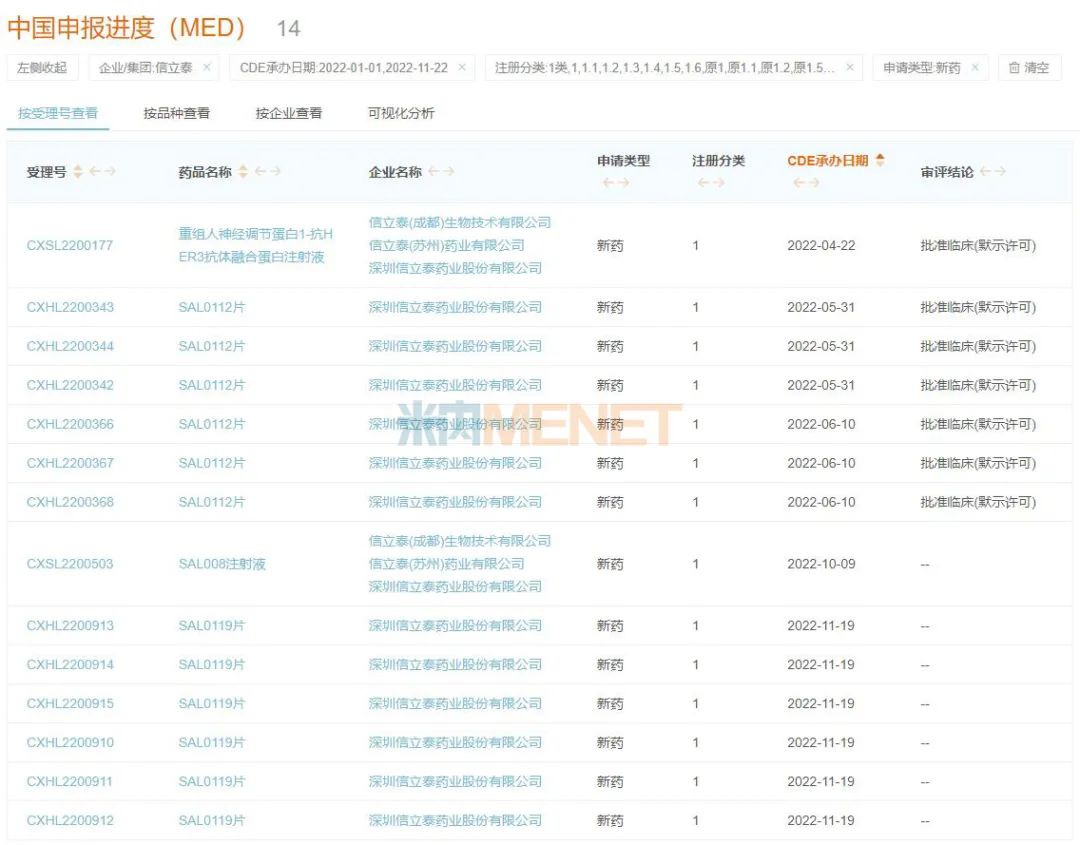
來源:米內(nèi)網(wǎng)新版數(shù)據(jù)庫
截至目前,信立泰在今年已申報(bào)了4款1類新藥,其中重組人神經(jīng)調(diào)節(jié)蛋白1-抗HER3抗體融合蛋白注射液和SAL0112片已獲批臨床。
據(jù)悉,重組人神經(jīng)調(diào)節(jié)蛋白1-抗HER3抗體融合蛋白注射液是信立泰第一個(gè)中美雙報(bào)的創(chuàng)新生物藥,目前HFrEF(射血分?jǐn)?shù)保留的心衰)適應(yīng)癥正在中美開展I期臨床研究。
而SAL0112片是一款GLP-1R的口服小分子偏向激動(dòng)劑,目前包括2型糖尿病、成人肥胖患者或超重患者的體重管理的適應(yīng)癥均已獲批臨床。
SAL008注射液是一款I(lǐng)L-15/IL-15Rα復(fù)合物與抗CTLA-4抗體的融合蛋白,擬用于晚期實(shí)體瘤的治療,目前國內(nèi)的新藥臨床申請(qǐng)正在審評(píng)審批中。該新藥在歐洲提交CTA(歐洲臨床試驗(yàn)申請(qǐng))后,已啟動(dòng)Ⅰ期臨床研究。
資料來源:CDE官網(wǎng)、公司公告、米內(nèi)網(wǎng)數(shù)據(jù)庫
注:米內(nèi)網(wǎng)《中國三大終端6大市場(chǎng)藥品競(jìng)爭格局》,統(tǒng)計(jì)范圍是:城市公立醫(yī)院和縣級(jí)公立醫(yī)院、城市社區(qū)中心和鄉(xiāng)鎮(zhèn)衛(wèi)生院、城市實(shí)體藥店和網(wǎng)上藥店,不含民營醫(yī)院、私人診所、村衛(wèi)生室,不含縣鄉(xiāng)村藥店;上述銷售額以產(chǎn)品在終端的平均零售價(jià)計(jì)算。數(shù)據(jù)統(tǒng)計(jì)截至11月23日,如有疏漏,歡迎指正!

