1月6日訊 1月5日,NMPA官網(wǎng)公布了最新的藥品批準(zhǔn)信息,齊魯制藥一舉拿下三個產(chǎn)品:曲氟尿苷替匹嘧啶片國內(nèi)首仿、鹽酸法舒地爾注射液首家過評、鹽酸普拉克索片國內(nèi)第三家。米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前齊魯?shù)亩髑麨I膠囊3類仿制上市申請也進入了“在審批”狀態(tài),有望在近期迎來好消息。
圖1:齊魯制藥最新獲批的產(chǎn)品情況

來源:NMPA官網(wǎng)
曲氟尿苷替匹嘧啶片首仿定了
據(jù)悉,曲氟尿苷替匹嘧啶片是曲氟尿苷(FTD)與鹽酸替匹嘧啶(TPI)以1:0.5的摩爾比組成的一種口服復(fù)方制劑,用于治療轉(zhuǎn)移性結(jié)直腸癌,原研廠家為日本大鵬,2019年8月獲NMPA批準(zhǔn)進口。
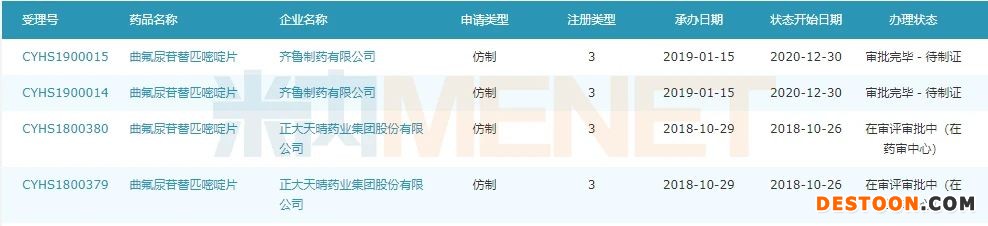
圖2:曲氟尿苷替匹嘧啶片申報上市的企業(yè)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前申報曲氟尿苷替匹嘧啶片仿制上市的企業(yè)有2家,正大天晴首家申報,但最終被齊魯搶先拿下首仿。
鹽酸法舒地爾注射液首家過評
鹽酸法舒地爾注射液的適應(yīng)癥為改善和預(yù)防蛛網(wǎng)膜下腔出血術(shù)后的腦血管痙攣及引起的腦缺血癥狀,在中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構(gòu))終端銷售額曾在2015年達到接近10億的規(guī)模,近幾年增速出現(xiàn)下滑態(tài)勢,2019年剩不到5億規(guī)模,但該產(chǎn)品在周圍血管擴張藥注射劑榜單中排在TOP2,市場地位依舊強勁。企業(yè)競爭格局方面,2020上半年天津紅日藥業(yè)以57.62%的份額領(lǐng)軍市場,齊魯制藥的市場份額不到1%。
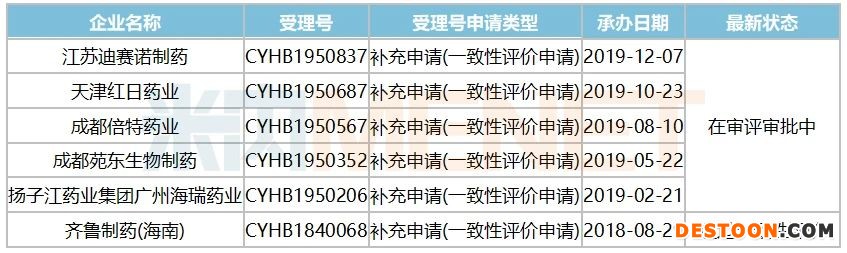
表1:申報鹽酸法舒地爾注射液一致性評價補充申請的企業(yè)情況
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫
目前,除了齊魯首家過評外,申報鹽酸法舒地爾注射液一致性評價補充申請的企業(yè)還有揚子江、苑東、倍特、紅日等5家,亞寶藥業(yè)按新分類申報也正在審評審批中。
鹽酸普拉克索片國內(nèi)第三家
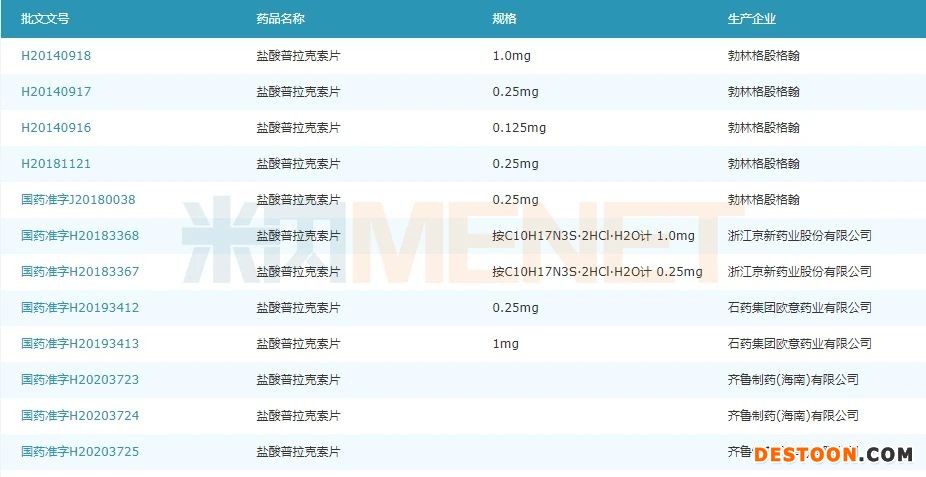
圖3:目前獲得鹽酸普拉克索片批文的企業(yè)情況
來源:米內(nèi)網(wǎng)一鍵檢索
鹽酸普拉克索片用于治療特發(fā)性帕金森病的體征和癥狀,單獨(無左旋多巴)或與左旋多巴聯(lián)用。在中國公立醫(yī)療機構(gòu)終端抗帕金森氏病藥產(chǎn)品TOP20中,2019年鹽酸普拉克索片以接近7億的銷售額排在首位。目前國內(nèi)市場中勃林格殷格翰占據(jù)了超九成的市場,京新藥業(yè)于2018年拿下首仿(2020年10月通過一致性評價),石藥于2020年1月以4類仿制獲批并視同過評,齊魯本次也是按4類仿制獲批,成為國內(nèi)第三家“獲批+過評”企業(yè)。
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、NMPA官網(wǎng)
審評數(shù)據(jù)統(tǒng)計截至2021年1月5日,如有錯漏,敬請指正。



 110102000668(1)號
110102000668(1)號