體外診斷(IVD)應該是2020年醫(yī)療器械行業(yè)最“出圈”的細分領域了,作為新冠病毒的主要的檢測手段之一,疫情的爆發(fā)使得IVD行業(yè)獲得了巨大的曝光量,讓大眾普遍認識到了該行業(yè)的重要性。但與此同時,行業(yè)中存在的一系列短板問題也加速暴露了出來。本文通過探討體外診斷領域存在的短板問題,提供了可能的解決路徑,以此期望能為IVD領域的快速發(fā)展添磚加瓦。
一、疫情推動下加速暴露的IVD行業(yè)隱患
新冠疫情爆發(fā)以來到現(xiàn)在已經(jīng)過去整整一年,在這一年里中國政府以其強大的魄力,在全世界范圍內(nèi)率先擺脫了新冠疫情的影響,實現(xiàn)了經(jīng)濟的回暖。而其他國家隨著疫情的二次爆發(fā),持續(xù)陷入經(jīng)濟衰退的陷阱之中,由此中國也不可避免得成為其他各國轉(zhuǎn)移內(nèi)部矛盾的靶標。其中在疫情中大顯身手的IVD行業(yè)正是處于西方國家“卡脖子”的風險地帶。拿新冠檢測試劑來舉例,快速檢測新冠抗體試紙條中的核心原料硝酸纖維素膜(NC膜),基本被國外廠商所壟斷,鮮有國內(nèi)廠商的產(chǎn)品被大規(guī)模的使用。這也導致了在疫情爆發(fā)初期,一卷NC膜的價格被炒高了好幾倍還“一票難求”。同樣的,新冠病毒核酸檢測試劑中最基礎的蛋白酶K,其基本供應商都來自國外,差點也被卡了脖子。
其實對于IVD的“卡脖子”領域,也并非是在疫情發(fā)生之后才開始顯現(xiàn),從行業(yè)發(fā)展之初,這些問題就普遍存在,只是在疫情的推動下加速暴露了出來。因此需要我們時刻去警惕該產(chǎn)業(yè)鏈中存在的隱患,及時采取措施來增強整個供應鏈的穩(wěn)定性,這對于整個產(chǎn)業(yè)的安全,尤其是事關國計民生的領域至關重要。
二、從技術及產(chǎn)業(yè)角度看目前IVD行業(yè)存在的短板
1. 從技術角度看
目前國內(nèi)的體外診斷廠家基本集中在中游產(chǎn)品的研發(fā)生產(chǎn)領域,對于上游原材料的及關鍵核心的元器件的涉獵程度還是不夠的,核心技術普遍還是掌握在幾個國際巨頭手中。究其原因,一方面是國內(nèi)生物醫(yī)藥領域的技術雖然在近幾年有了長足的發(fā)展,但是在核心領域還是與國外有著不小的差距;另一方面是該領域的企業(yè)大多還是以中小型為主,很少有企業(yè)能夠投入大量的資金及時間去進行周期長且難度大的基礎性研究。但是我們也要意識到,在整個體外診斷產(chǎn)品當中,這些核心的原材料往往占據(jù)著大部分的成本,且國內(nèi)企業(yè)對此基本沒有議價能力。這就導致了如果國外企業(yè)一旦斷供這些原料,那么國內(nèi)許多企業(yè)立馬就會陷入無法生存的境地。
(1)IVD試劑原料
IVD試劑原料涵蓋范圍廣泛,涉及抗體、抗原、酶等關鍵的活性物質(zhì),其主要決定了IVD產(chǎn)品的核心性能(靈敏度、線性及穩(wěn)定性等)。試劑原料的市場規(guī)模從2014年的35.4億增長至2019年的78.4億人民幣,年復合增長率達到了17.2%。預計在未來五年,IVD試劑原料的市場規(guī)模將保持在15%以上的增長速率,在2023年達到140億人民幣。
從IVD的試劑原材料產(chǎn)業(yè)鏈來看,上游的材料質(zhì)量性能水平成為體外診斷試劑原材料行業(yè)發(fā)展的關鍵因素。
圖1 IVD試劑原材料產(chǎn)業(yè)鏈
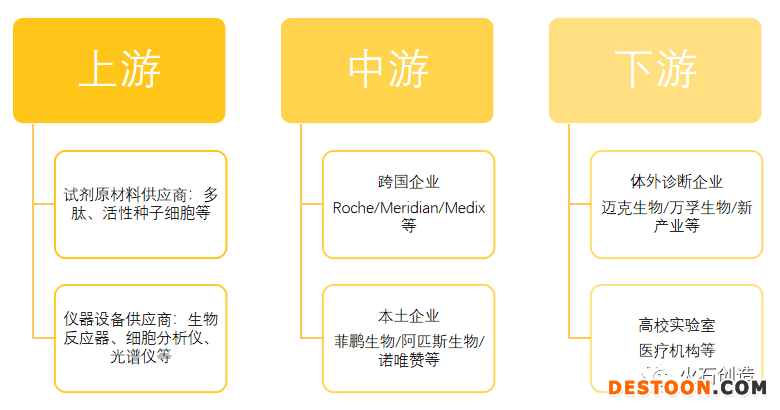
圖片來源:火石創(chuàng)造根據(jù)公開資料整理
中游的核心原材料基本被跨國企業(yè)所壟斷,如Hytest的心肌標志物的原料,Meridian的寄生蟲、真菌檢測原料,龜甲萬的糖化血紅蛋白原料等。而本土的企業(yè)鮮有以試劑原料作為主營成長為行業(yè)龍頭的公司,菲鵬生物作為其中領軍者,目前在原料領域發(fā)展勢頭強勁。其余體外診斷的上市公司雖然也逐漸開始去探索原料的開發(fā),如安圖生物、萬孚生物等都在進行抗體抗原、微球磁珠的開發(fā),但是在核心原材料層面,國內(nèi)本土企業(yè)幾乎無法參與生產(chǎn),導致下游的IVD生產(chǎn)企業(yè)對進口原料的依賴程度極高。與此同時,由于跨國企業(yè)的先發(fā)優(yōu)勢,其原材料中的大部分成本主要集中在材料,對于研發(fā)的投入已經(jīng)完成,因此其生產(chǎn)成本極低,利潤極高,有相當程度的降價的空間。因此國內(nèi)企業(yè)想要在原料領域追趕上跨國巨頭的腳步,不但需要在產(chǎn)品質(zhì)量上有所突破,成本上更是要控制在比較合適的范圍內(nèi),這樣才能與之抗衡。目前IVD行業(yè)中核心原材料的現(xiàn)狀如下表所示:
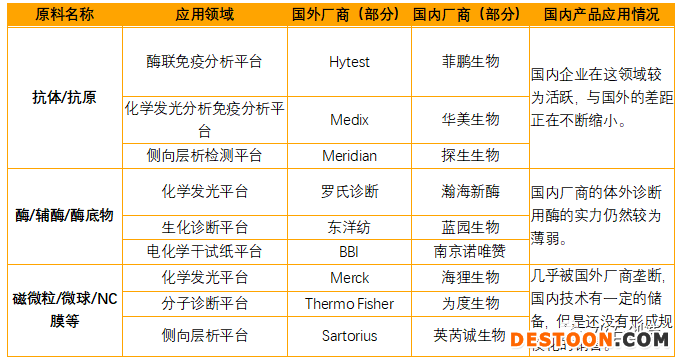
數(shù)據(jù)來源:火石創(chuàng)造根據(jù)公開的資料整理
?。?)IVD儀器
IVD儀器領域被關注的程度不如試劑原材料那么高,主要由于比較成熟的領域(如生化試劑領域),儀器基本處于開放狀態(tài),國產(chǎn)廠家的試劑只要去適配市面上現(xiàn)有的儀器即可,而高端的體外診斷設備和試劑基本上是一體化的封閉體系,這就會導致各個廠家的儀器都是非標準化的設計,沒有較為統(tǒng)一的標準。此外,由于IVD的儀器是多學科交叉的領域,整合了高速自動化、精密光學、非標結(jié)構、集成電路、流體力學和生物學等多種學科,同時體外診斷儀器開發(fā)的人員在初始階段幾乎都是從其他電子儀器行業(yè)轉(zhuǎn)行過來的,對于診斷儀器這種多學科交叉的儀器開發(fā)訓練不夠系統(tǒng),對于相關的法律法規(guī)也不夠熟悉,因此只有幾個頭部的企業(yè)才有實力去開發(fā)與試劑相應的大型配套儀器,中小廠家的IVD儀器開發(fā)主要分布在小型或自動化程度較低的POCT儀器上為多。該領域國內(nèi)比較缺乏的核心元器件如表2所示,目前國內(nèi)核心元器件生產(chǎn)能力缺乏的原因主要還是加工的工藝達不到足夠的精度造成的。
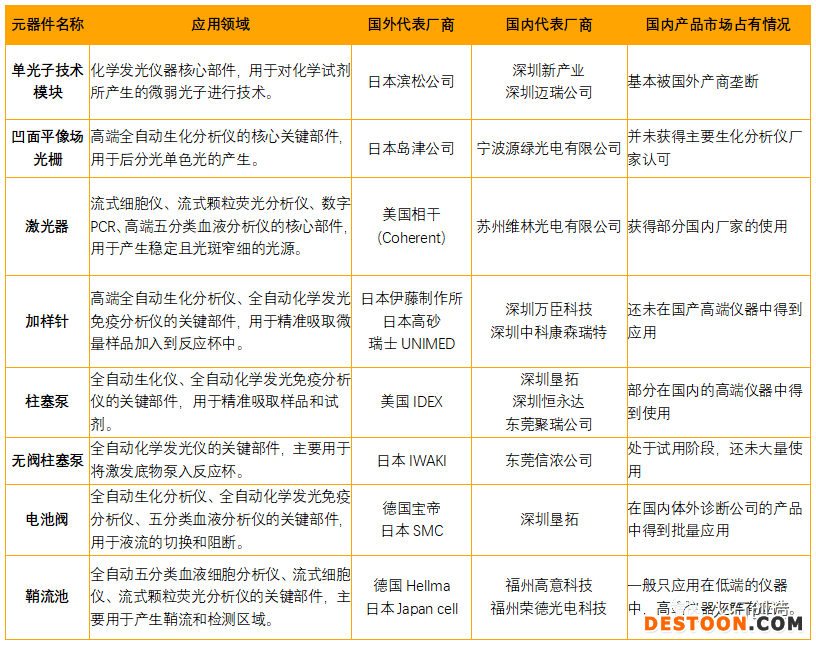
數(shù)據(jù)來源:火石創(chuàng)造根據(jù)公開資料整理
2. 從產(chǎn)業(yè)的角度看
IVD產(chǎn)業(yè)在我國是一個強監(jiān)管的產(chǎn)業(yè),產(chǎn)品的生產(chǎn)上市需要取得國家食品藥品監(jiān)督管理局頒發(fā)的注冊證書及生產(chǎn)許可證。這些證書的獲取其實是有一定門檻的,比如一個普通的二類器械產(chǎn)品從立項到產(chǎn)品上市需要分別經(jīng)過設計開發(fā)、小試中試、注冊檢驗、臨床試驗、質(zhì)量體系考核、注冊審批等階段,不僅需要投入技術、資金、人員,更是需要一段時間去獲取批件。而在這個行業(yè)中絕大部分是資源較為匱乏的小企業(yè)或是初創(chuàng)型企業(yè),這些企業(yè)在技術上可能相對先進,但在資金及時間上普遍是較為緊張的,很多小企業(yè)由于遲遲拿不到批件,產(chǎn)品無法及時上市,資金得不到回籠而倒閉。而資金相對充裕的初創(chuàng)企業(yè),由于沒有相關的行業(yè)經(jīng)驗,不熟悉注冊審批及臨床試驗的流程,不斷地在修改提交的材料和整改生產(chǎn)的現(xiàn)場,在這些環(huán)節(jié)上浪費了大量的時間,這同樣不利于產(chǎn)品的快速推出。
另一方面,目前國內(nèi)的IVD產(chǎn)品的同質(zhì)化現(xiàn)象比較嚴重,銷售訂單很多情況下是靠壓低售價相互惡性競爭來達成的。而同時國內(nèi)大多三甲醫(yī)院對國產(chǎn)的IVD產(chǎn)品仍不夠信任,寧愿出更高的價格去購買跨國公司的產(chǎn)品,也不太認可國內(nèi)產(chǎn)品的品質(zhì)。究其原因還是國內(nèi)廠商在研發(fā)端的投入偏少,產(chǎn)品本身的可靠程度還有待進一步去改善。此外在產(chǎn)品設計及品牌推廣上的手段和力度也和跨國企業(yè)相差甚遠,難以形成品牌效應,得不到廣泛的認可。
三、IVD產(chǎn)業(yè)的發(fā)展建議
1. 明確IVD產(chǎn)業(yè)鏈及創(chuàng)新鏈,有針對性強化鏈條
首先對國內(nèi)IVD的產(chǎn)業(yè)鏈進行全面梳理,識別產(chǎn)業(yè)鏈中存在的優(yōu)勢及瓶頸領域,有針對性的進行補鏈及強鏈,加強供應鏈的穩(wěn)定性。同時圍繞產(chǎn)業(yè)鏈來部署IVD產(chǎn)業(yè)的創(chuàng)新鏈,深入產(chǎn)品整個生命周期的各個階段,將對應的人才及資金資源合理分配到產(chǎn)品周期的每個環(huán)節(jié)中。同時加大研發(fā)端的投入,進一步深化產(chǎn)學研的結(jié)合,將高校及科研院所的平臺及人才資源利用起來,出臺利好的政策保障,改善科研人員在研究成果中的收益分配,提升IP轉(zhuǎn)化的效率。
2. 加速醫(yī)療器械外包服務的發(fā)展
IVD產(chǎn)業(yè)的分工可以進一步的細化,加快醫(yī)療器械研發(fā)、注檢、臨床等一站式外包服務的發(fā)展。協(xié)助企業(yè)從源頭建立起合理化、規(guī)范化的管理制度,同時減少前期的投入成本,尤其是幫助初創(chuàng)型公司少走彎路,減少研發(fā)的風險,加快企業(yè)產(chǎn)品從設計開發(fā)到落地拿證的速度,使得產(chǎn)品能夠快速上市。
3. 加速數(shù)字化平臺的建設,對產(chǎn)業(yè)進行精準化的治理
建設數(shù)字化的服務平臺,將線下的實體企業(yè)進行線上數(shù)字化,平臺整合區(qū)域的空間、人才、資本、政策等資源,通過線上的服務資源的虛擬聚集,擴大服務的邊界。對企業(yè)的需求進行快速響應,實現(xiàn)精準化的資源匹配。不斷促進產(chǎn)業(yè)的聚集,提升產(chǎn)業(yè)的創(chuàng)新能力,同時促進區(qū)域的產(chǎn)業(yè)發(fā)展降本增效,實現(xiàn)對產(chǎn)業(yè)精準化的治理。
4. 發(fā)揮本土企業(yè)的優(yōu)勢,緩解卡脖子現(xiàn)象
由于目前IVD行業(yè)發(fā)展非常迅速,終端用戶的需求也在不斷的變化當中。相對于跨國企業(yè)來說,本土企業(yè)在對變化需求的響應上速度更快,溝通更便利,服務也可以做得更到位,尤其是對定制化的產(chǎn)品,整個供貨的周期會更短。此外,一般情況下,本土企業(yè)的產(chǎn)品在價格上相比于跨國企業(yè)更有優(yōu)勢。參考國內(nèi)的智能手機行業(yè)的發(fā)展軌跡,只要本土企業(yè)的IVD產(chǎn)品質(zhì)量能夠達到與跨國企業(yè)相差無幾的地步,相信屆時國內(nèi)的市場應該是本土企業(yè)的天下了。
總結(jié)
雖然新冠疫情大大加快了國內(nèi)IVD產(chǎn)業(yè)的發(fā)展步伐,但我們應該清醒認識到這個行業(yè)仍存在諸多的不足及“卡脖子”現(xiàn)象,國內(nèi)的市場依舊被跨國巨頭所占據(jù)的現(xiàn)實?,F(xiàn)階段我國“經(jīng)濟內(nèi)循環(huán)”的趨勢之下,應利用國內(nèi)良好的互聯(lián)網(wǎng)基礎優(yōu)勢,重點布局工業(yè)聯(lián)網(wǎng)的建設來賦能產(chǎn)業(yè)的發(fā)展,將人才、技術、資金和政策進行合理的組合與配置,實現(xiàn)IVD產(chǎn)業(yè)的跨越式發(fā)展,盡快擺脫“卡脖子”的風險。



 110102000668(1)號
110102000668(1)號