近日,豪森藥業(yè)研發(fā)管線有新進(jìn)展:首款生物藥獲批,1類新藥HS-10380、HS-10370獲批臨床,4類仿制藥瑞戈非尼報(bào)產(chǎn)......豪森藥業(yè)堅(jiān)持創(chuàng)新與國際化雙輪驅(qū)動,目前有31款創(chuàng)新藥(27款1類新藥)處于申請臨床及以上階段,第6款1類新藥、第2款口溶膜上市可期;37個品種過評(21個首家),6個品種擬納入第七批集采,7個品種搶首仿(3個獨(dú)家申報(bào))。
首款生物藥獲批,27款1類新藥在路上
近段時間,豪森藥業(yè)創(chuàng)新藥研發(fā)動態(tài)頻發(fā):伊奈利珠單抗(Inebilizumab)獲批上市,為公司首款生物藥;1類新藥HS-10380、HS-10370接連獲批臨床,分別用于治療精神分裂癥及晚期實(shí)體瘤。
伊奈利珠單抗(Inebilizumab)是豪森藥業(yè)以超2.2億美元引進(jìn)的一款CD19單抗,用于治療視神經(jīng)脊髓炎譜系障礙。這是豪森藥業(yè)第6款獲批上市的創(chuàng)新藥,同時也是公司首款獲批的生物藥。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前豪森藥業(yè)有31款創(chuàng)新藥處于申報(bào)臨床及以上階段(不含已上市新藥申報(bào)新適應(yīng)癥),涵蓋抗腫瘤、神經(jīng)系統(tǒng)、抗感染、消化道、心血管等治療領(lǐng)域,其中27款為1類新藥。
豪森藥業(yè)在研創(chuàng)新藥
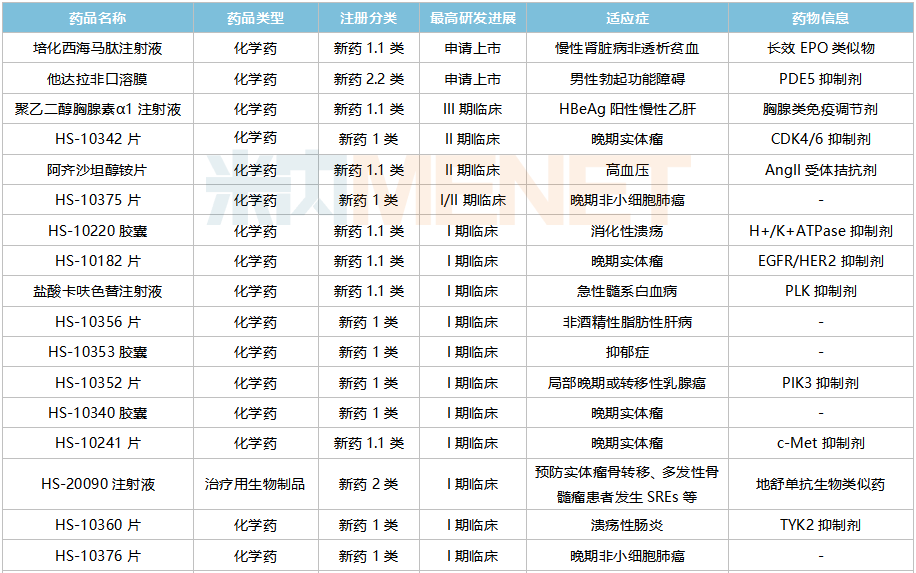
來源:米內(nèi)網(wǎng)中國藥品臨床試驗(yàn)公示庫
豪森藥業(yè)在研新藥集中在化學(xué)藥上,5款1類新藥已獲批上市,此外,5款1類新藥處于II期及以上研發(fā)階段(含I/II期),其中培化西海馬肽注射液已報(bào)產(chǎn),這是一種長效的新型多肽類促紅細(xì)胞生成素(EPO)受體激動劑,有望成為國內(nèi)首款國產(chǎn)長效EPO藥物。
改良型新藥緊盯口溶膜制劑,該劑型產(chǎn)品具有服用及攜帶方便、用藥依從性高、起效速度快等優(yōu)點(diǎn)。豪森藥業(yè)首款口溶膜奧氮平口腔速溶膜已獲批上市,他達(dá)拉非口溶膜的上市申請還在審。米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前國內(nèi)已有5款口溶膜(以藥品名+企業(yè)名計(jì))獲批,其中齊魯制藥獨(dú)占3款。
在生物藥方面,首款新藥伊奈利珠單抗(Inebilizumab)已獲批上市,處于I期臨床的注射用HS-20093、注射用HS-20089均為抗腫瘤藥;1款生物類似藥在研,HS-20090注射液為地舒單抗生物類似藥,目前正在開展I期臨床,安進(jìn)的地舒單抗(骨質(zhì)疏松)2021年全球銷售額超過30億美元。
21個品種首家過評,6個品種擬納入第七批集采
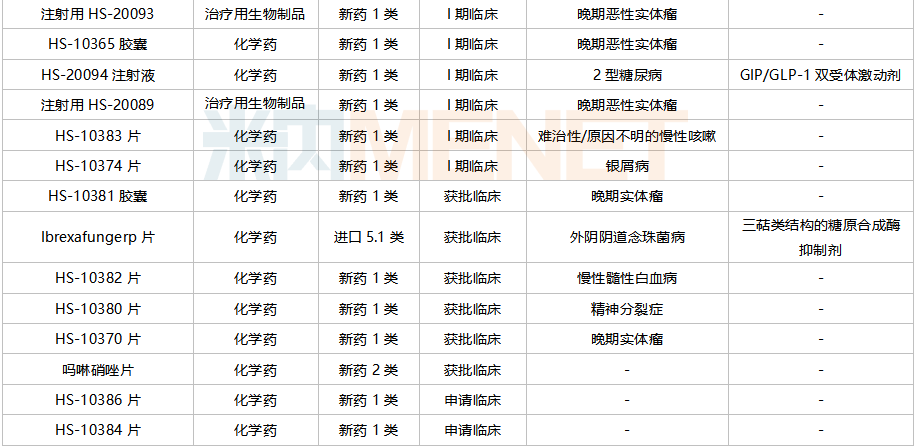
在仿制藥方面,目前豪森藥業(yè)有37個品種通過或視同通過一致性評價(jià),涵蓋6個治療大類,集中在抗腫瘤和免疫調(diào)節(jié)劑(13個品種)及消化系統(tǒng)及代謝藥(8個品種);21個品種首家過評,其中酒石酸唑吡坦片、恩雜魯胺軟膠囊、酒石酸伐尼克蘭片為獨(dú)家過評。
豪森藥業(yè)過評品種
注:帶*為首家/獨(dú)家過評
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫
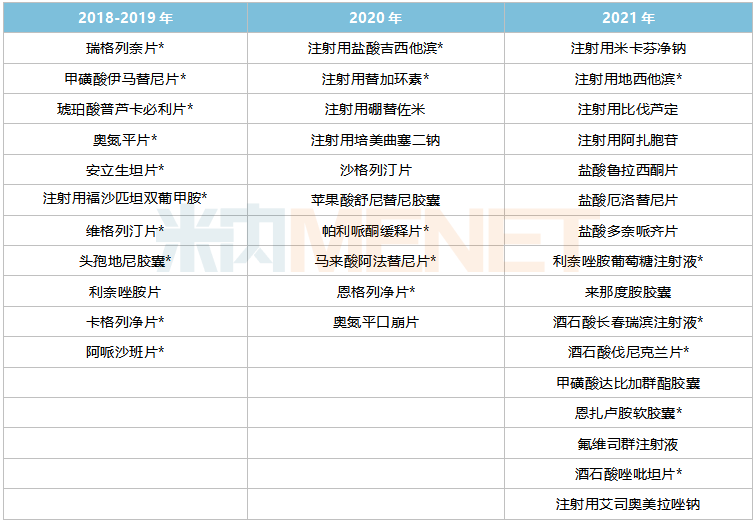
在已落地執(zhí)行的五批國家集采中,豪森藥業(yè)分別有2個、1個、5個、4個、5個品種中選,累計(jì)17個品種。在即將開展的第七批集采,豪森藥業(yè)有6個過評品種擬納入其中。
豪森藥業(yè)擬納入第七批集采的過評品種
注:銷售額低于1億元用*代表
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、上海陽光醫(yī)藥采購網(wǎng)
從競爭情況看,6款產(chǎn)品競爭格局均相對良好;從市場格局看,豪森藥業(yè)在鹽酸魯拉西酮片、厄洛替尼口服常釋劑型、阿法替尼口服常釋劑型、舒尼替尼口服常釋劑型等品種的市場正待開拓,有望通過集采中選實(shí)現(xiàn)放量。
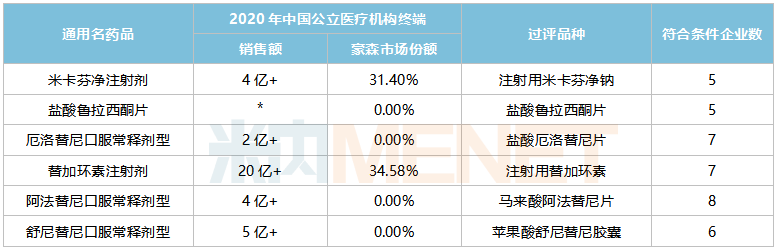
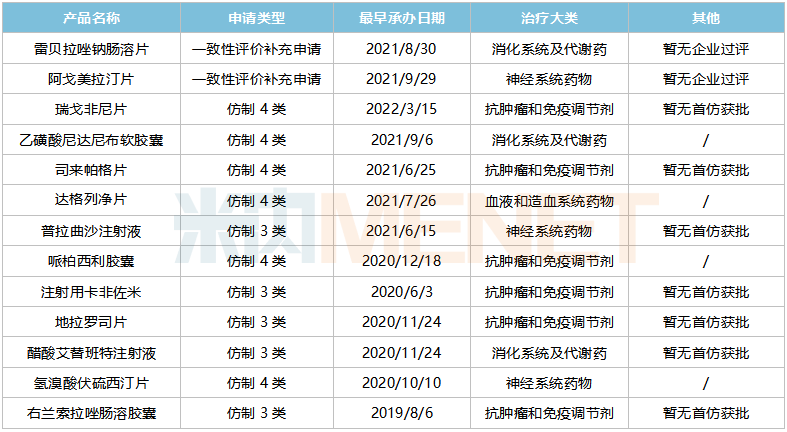
在審的一致性評價(jià)品種中,雷貝拉唑鈉腸溶片、阿戈美拉汀片提交一致性評價(jià)補(bǔ)充申請,這2個品種均暫無企業(yè)過評,在2020年中國公立醫(yī)療機(jī)構(gòu)終端的銷售額分別超過20億元、3億元;11個品種以新分類報(bào)產(chǎn),其中7個暫無首仿獲批(含劑型首仿)。
豪森藥業(yè)在審的一致性評價(jià)品種(含新分類申報(bào))
來源:米內(nèi)網(wǎng)MED2.0中國藥品審評數(shù)據(jù)庫
地拉羅司片、司來帕格片、普拉曲沙注射液由豪森藥業(yè)獨(dú)家以新分類報(bào)產(chǎn)。司來帕格是強(qiáng)生開發(fā)的一款口服IP前列環(huán)素受體激動劑,屬于罕見病用藥,2021年全球銷售額超過10億美元;地拉羅司是由諾華研發(fā)的鐵螯合劑產(chǎn)品,是FDA批準(zhǔn)的第一個能夠常規(guī)使用的口服驅(qū)鐵劑,全球銷售峰值超過10億美元。
拿下8個ANDA,首款創(chuàng)新藥實(shí)現(xiàn)海外授權(quán)
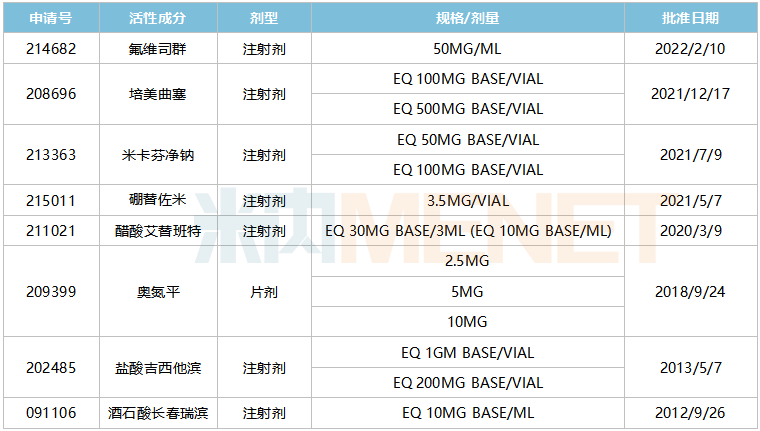
研發(fā)創(chuàng)新與國際化是豪森藥業(yè)兩大發(fā)展戰(zhàn)略,從2012年開始,公司就陸續(xù)有仿制藥在美國獲批上市,至今已有8個產(chǎn)品獲得FDA批準(zhǔn)的ANDA文號。
豪森藥業(yè)已獲得批準(zhǔn)的ANDA文號
來源:米內(nèi)網(wǎng)全球上市藥物庫
7個為注射劑,其中醋酸艾替班特注射劑在國內(nèi)僅原研產(chǎn)品獲批,豪森藥業(yè)的產(chǎn)品于2020年11月報(bào)產(chǎn),與成都圣諾生物搶首仿。
在創(chuàng)新藥國際化方面,豪森藥業(yè)已實(shí)現(xiàn)首個創(chuàng)新藥海外授權(quán)協(xié)議。2020年7月,豪森藥業(yè)與美國EQRx公司簽署海外合作協(xié)議,以超1億美元轉(zhuǎn)讓阿美替尼(HS-10296)海外開發(fā)及商業(yè)化權(quán)益。此次“出海”合作,將加快豪森藥業(yè)創(chuàng)新成果的國際化布局,提升創(chuàng)新品牌和海外業(yè)績。
HS-10241澳大利亞臨床試驗(yàn)進(jìn)展

來源:米內(nèi)網(wǎng)新版數(shù)據(jù)庫
此外,HS-10241實(shí)體瘤適應(yīng)癥已在澳大利亞完成I期臨床試驗(yàn),這是一款高選擇性c-Met抑制劑,目前全球已有多款同靶點(diǎn)藥物獲批上市,包括默克的特泊替尼(Tepotinib)、諾華/Incyte的卡瑪替尼(Capmatinib)、和記黃埔的賽沃替尼(savolitinib)等。
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫等
注:數(shù)據(jù)統(tǒng)計(jì)截至3月21日,如有疏漏,歡迎指正!



