9月10日訊 9月8日下午,國家藥監(jiān)局發(fā)布《關(guān)于注銷注射用前列地爾等78個(gè)藥品注冊證書的公告》(2020年第96號(hào))。
公告指出,根據(jù)《中華人民共和國藥品管理法實(shí)施條例》和《藥品注冊管理辦法》的有關(guān)規(guī)定,國家藥品監(jiān)督管理局決定注銷注射用前列地爾等78個(gè)藥品注冊證書。
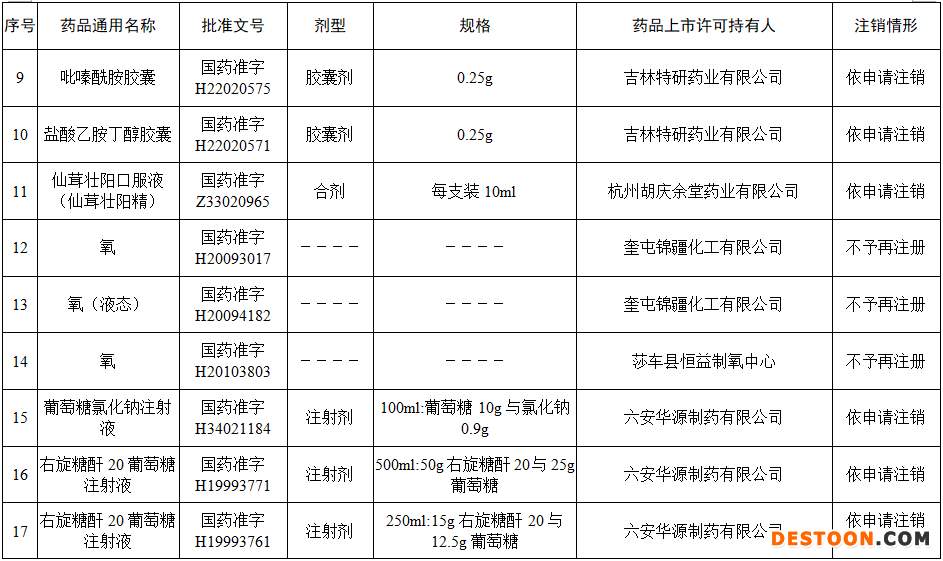
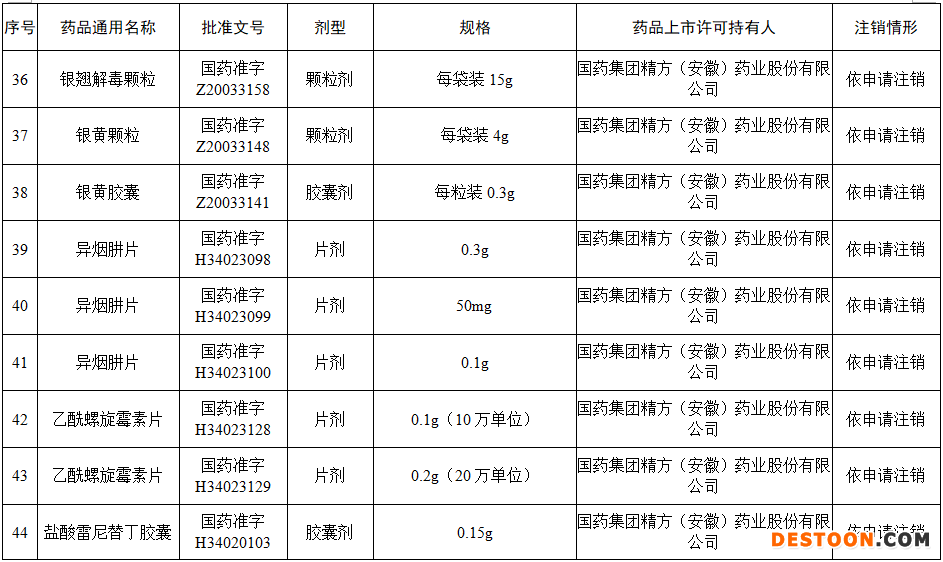
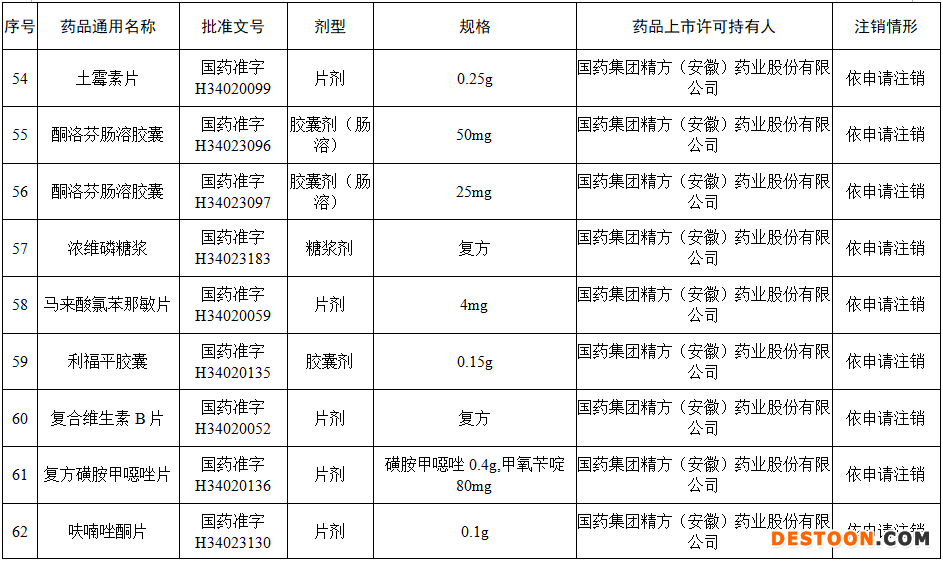
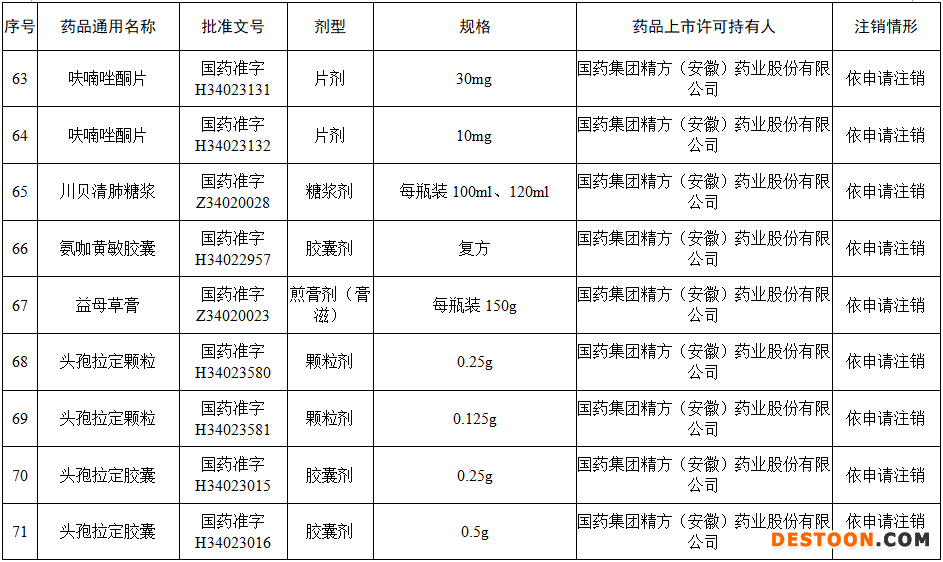
據(jù)賽柏藍(lán)梳理,本次注銷藥品注冊證書的藥品有:小兒氨酚黃那敏顆粒、注射用前列地爾、馬來酸氯苯那敏片、頭孢拉定顆粒、頭孢氨芐顆粒、阿莫西林膠囊、異煙肼片、銀黃顆粒、鹽酸雷尼替丁膠囊等常見品種。
本次注銷批文的78個(gè)藥品主要涉及吉林特研藥業(yè)、杭州胡慶余堂藥業(yè)、六安華源制藥、國藥集團(tuán)精方(安徽)藥業(yè)、三九集團(tuán)昆明白馬制藥等。
值得注意的是在上述藥企中有兩家藥企注銷的藥品批文數(shù)量最多,一家是六安華源制藥,一家是國藥集團(tuán)精方(安徽)藥業(yè)——其中,六安華源制藥注銷的藥品批文數(shù)量達(dá)21個(gè);國藥集團(tuán)精方(安徽)藥業(yè)注銷的藥品批文數(shù)量達(dá)42個(gè)。
另外,這78個(gè)藥品除去3個(gè)不予再注冊,一個(gè)依法注銷外,其余74個(gè)藥品均是依申請注銷,也就是說是企業(yè)主動(dòng)申請注銷了持有的批文。
等同退出市場,不能用了
據(jù)賽柏藍(lán)查詢,根據(jù)新版《藥品注冊管理辦法》規(guī)定,藥品注冊證書有效期為五年,藥品注冊證書有效期內(nèi)持有人應(yīng)當(dāng)持續(xù)保證上市藥品的安全性、有效性和質(zhì)量可控性,并在有效期屆滿前六個(gè)月申請藥品再注冊。
根據(jù)《中華人民共和國藥品管理法實(shí)施條例》,有效期屆滿,未申請?jiān)僮曰蛘呓?jīng)審查不符合國務(wù)院藥品監(jiān)督管理部門關(guān)于再注冊的規(guī)定的,注銷其藥品批準(zhǔn)文號(hào)、《進(jìn)口藥品注冊證》或者《醫(yī)藥產(chǎn)品注冊證》。
今年7月1日起正式施行的《藥品注冊管理辦法》第一百一十條規(guī)定,具有下列情形之一的,由國家藥品監(jiān)督管理局注銷藥品注冊證書,并予以公布:
?。ㄒ唬┏钟腥俗孕刑岢鲎N藥品注冊證書的;
?。ǘ┌凑毡巨k法規(guī)定不予再注冊的;
?。ㄈ┏钟腥怂幤纷宰C書、藥品生產(chǎn)許可證等行政許可被依法吊銷或者撤銷的;
(四)按照《藥品管理法》第八十三條的規(guī)定,療效不確切、不良反應(yīng)大或者因其他原因危害人體健康的;
(五)按照《疫苗管理法》第六十一條的規(guī)定,經(jīng)上市后評價(jià),預(yù)防接種異常反應(yīng)嚴(yán)重或者其他原因危害人體健康的;
?。┌凑铡兑呙绻芾矸ā返诹l的規(guī)定,經(jīng)上市后評價(jià)發(fā)現(xiàn)該疫苗品種的產(chǎn)品設(shè)計(jì)、生產(chǎn)工藝、安全性、有效性或者質(zhì)量可控性明顯劣于預(yù)防、控制同種疾病的其他疫苗品種的;
?。ㄆ撸┻`反法律、行政法規(guī)規(guī)定,未按照藥品批準(zhǔn)證明文件要求或者藥品監(jiān)督管理部門要求在規(guī)定時(shí)限內(nèi)完成相應(yīng)研究工作且無合理理由的;
(八)其他依法應(yīng)當(dāng)注銷藥品注冊證書的情形。
值得注意的是,根據(jù)新版《藥品管理法》的規(guī)定,禁止未取得藥品批準(zhǔn)證明文件生產(chǎn)、進(jìn)口藥品。也就是說,上述批文的原持有藥企將不能再生產(chǎn)上述藥品,且自注銷公告生效開始,已經(jīng)生產(chǎn)的上述藥品也將不能在市場上流通,否則將違反《藥品管理法》的相關(guān)規(guī)定。









 110102000668(1)號(hào)
110102000668(1)號(hào)